ПЭКома — очень редко встречающаяся злокачественная мезенхимальная опухоль, состоящая из периваскулярных эпителиоидных клеток с особыми гистологическими и иммуногистохимическими характеристиками, согласно определению Всемирной Организации Здравоохранения [1]. Впервые данная опухоль была описана в 1943 году [2]. Несмотря на редкость данной опухоли, существует классификация, позволяющая прогнозировать риск локального рецидива и отдалённого метастазирования после проведённого лечения, основанная на размерах опухоли и ряде её гистологических характеристик [3].
Тактика лечения больных этим заболеванием остаётся обсуждаемой. По мнению ряда авторов, единственным методом лечения, который, возможно, может привести к улучшению показателей выживаемости, является хирургический [2]. В литературе описаны случаи излечения больных ПЭКомой, во всяком случае, на момент публикации результатов наблюдения [4, 5]. Считается, что R0-резекции опухоли в состоянии привести к ремиссии в течение нескольких лет; циторедуктивные операции также могут помочь продлить жизнь таким больным.
Однако неудовлетворительные результаты вынуждают исследователей проводить поиск сочетания модальностей лечения, способного привести к достижению лучших показателей контроля болезни. Редкость болезни не способствует разработке единых критериев лечения ПЭКомы, поэтому метанализ 2012 года, включающий в себя 234 пациента, описанных в англоязычной литературе на тот момент, описывает самые разнообразные подходы к их лечению [6]. Другим неудовлетворительным аспектом анализируемого материала является, в основном, малый период наблюдения пролеченных пациентов: многие авторы публиковали результаты наблюдения спустя всего несколько месяцев после окончания лечения. Данный подход не даёт возможности сравнить эффективность лечения пациентов, получавших только хирургическое лечение, а также хирургическое в сочетание с неоадъювантным и адъювантным лечением различного объёма (лучевая терапия, химиотерапия, гормональная терапия).
Случай, описанный в данной статье, описывает эффективность неоадъювантной гормонолучевой терапии (но не комплексного лечения в силу небольшого периода наблюдения), поэтому группа авторов считает корректным привести здесь данные метанализа, посвящённые результатам схожих подходов терапии больных ПЭКомой.
6 пациентов из 222 (для которых были опубликованы какие-либо подробности проведённого лечения) были подвергнуты неоадъювантной терапии различного объёма. В 3 случаях перед операцией была проведена только химиотерапия, в 2 — только лучевая терапия, в 1 — последовательная химиолучевая терапия. В одном случае 9-летней девочке с ПЭКомой матки было проведено 2 курса химиотерапии винкристином, ифосфамидом и доксорубицином с 10%-ным уменьшением размеров опухоли, однако без значимых гистологических признаков терапевтического патоморфоза в послеоперационном материале. В связи с этим после операции была назначена конкурентная химиолучевая терапия. В течение 17 месяцев наблюдения после резекции не было выявлено признаков прогрессирования заболевания, однако у пациентки развилась острая лимфобластная лейкемия, связанная авторами с применением антрациклинов [7, 8]. Наиболее значительный ответ на неоадъювантное лечение был зафиксирован в виде 80%-ного уменьшения опухоли мягких тканей верхней конечности в ответ на 6 курсов химиотерапии доксорубицином и ифосфамидом с последующим прогрессированием (по данным авторов метанализа, авторы оригинальной статьи свидетельствуют о стабилизации опухолевого процесса) во время предоперационного курса дистанционной лучевой терапии с суммарной очаговой дозой 50 Гр. Была выполнена резекция опухоли, по данным патоморфологического исследования 20% опухолевых клеток были некротизированы (что, вероятно, следует расценивать как признак I степени лечебного патоморфоза по шкале Лавниковой/Dworak) [9]. В течение 21 месяца наблюдения локальный рецидив не был выявлен, однако было выявлено метастатическое поражение лёгких. В двух других случаях проведения химиотерапии в неоадъювантном периоде было зафиксировано прогрессирование процесса в процессе лечения [10] и живая опухолевая ткань в послеоперационном материале [3]. В наблюдениях больных, которым в неоадъювантном периоде была проведена только лучевая терапия, не приводятся данные патоморфологического ответа в операционном материале [11, 12].
Подытоживая этот материал, авторы метанализа сообщают о том, что 5 из 6 приведённых случаев могут быть отнесены к «злокачественным» в соответствии с критериями Folpe, и только один случай (последовательной химиолучевой терапии) может считаться свидетельством значимого ответа на неоадъювантное лечение.
Пациент Н., 43 года.
Диагноз: внеорганная ПЭКома малого таза. Состояние после хирургического лечения 27.08.2015. Рецидив заболевания, состояние после комплексного лечения.
В мае 2015 года начали беспокоить боли в области левого тазобедренного сустава. При обследовании выявлен асептический некроз головки левой бедренной кости IV стадии с её импрессионным переломом, синовит левого тазобедренного сустава. Кроме этого, случайной находкой обследования оказалось узловой образование 6,0×6,0×7,0 см в параректальной клетчатке, тесно прилегающее к левой стенке прямой кишки без чёткой границы. Нельзя исключить, что образование исходит из стенки кишки (по данным КТ от 30.07.15).
В августе 2015 года по месту жительства было выполнена лапаратомия, удаление опухоли. При гистологическом исследовании опухоль состояла из крупных клеток со светлой и слабо эозинофильной цитоплазмой, формирующих гнезда (рис. 1).
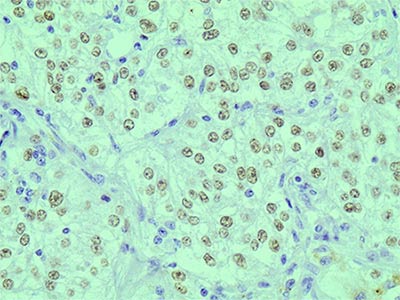
Рис.1. Опухоль состоит из крупных клеток со светлой цитоплазмой и округлыми ядрами с ядрышками. Гем.-эозин, х 400.
Гнезда разделены тонкими соединительнотканными прослойками с капиллярами. Ядра опухолевых клеток относительно однотипны, с четкими ядрышками и единичными типичными митозами. При иммуногистохимическом исследовании в опухолевых клетках выявлена диффузная экспрессия HMB45 (рис. 2), Melan A и TPE3 (рис. 3). В части опухолевых клеток отмечалась слабая экспрессия общего актина, тогда как экспрессия гладкомышечного актина, калпонина и h-калдесмона отсутствовала. На основании данных светооптической микроскопии и результатов иммуногистохимического исследования был поставлен диагноз ПЭКома.
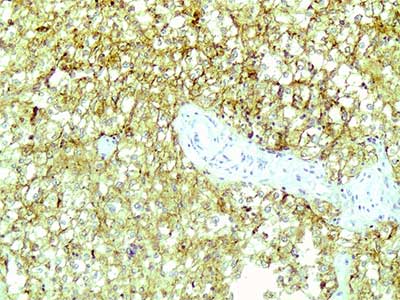
Рис.2. Характерным признаком этой опухоли является экспрессия HMB45. х 200.
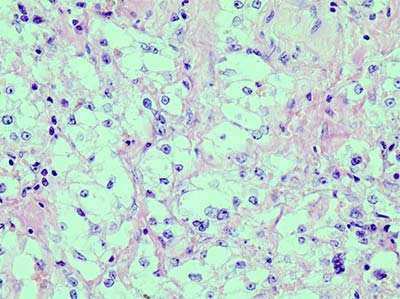
Рис. 3. Ядерная экспрессия TFE3. х 400.
В октябре 2015 года возник рецидив заболевания. По данным МРТ от 10.10.15 в ложе ранее удаленного образования определяется многоузловая опухоль размерами 3,1×3,5×3,7 см, солидной структуры, тесно прилегающая к стенке прямой кишки на протяжении 2,8 см (Рис.4)
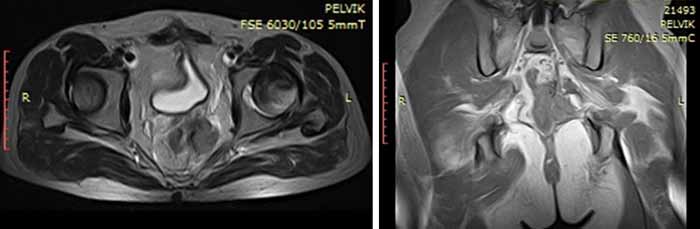
Рис.4. Магнитно-резонансная томография до начала лечения
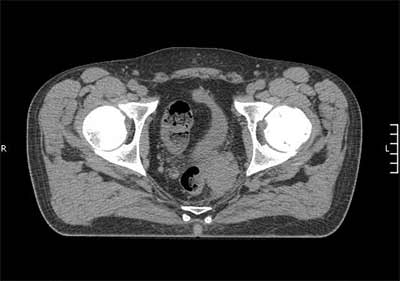
Рис.5. Компьютерная терапия до начала лечения
С ноября 2015 года по июнь 2016 года проводилась гормональная терапия препаратом «Провера» в дозе 500 мг в сутки.
С 23 по 27.11.15 проведён курс дистанционной лучевой терапии в режиме стереотаксической радиотерапии на рецидивную опухоль в параректальной клетчатке, РОД 6 Гр, ежедневно, СОД 30 Гр.
В течение последующего срока наблюдения продолжалась гормональная терапия проверой. При контрольных обследованиях, в том числе по данным МРТ от 30.03.16, отмечается небольшое уменьшение размеров опухоли, плотная капсула чётко ограничивает неоднородное содержимое, прямая кишка подтянута к опухолевому узлу.
16.06.16 было выполнено удаление рецидивной опухоли. После проведенного лечения размеры рецидивной опухоли составили 4,5×2,5×2,5 см. Около 70% опухоли замещено соединительной тканью с кристаллами холестерина и отложениями гемосидерина. В остаточной опухоли отмечаются дистрофические изменения и мелкие очаги некроза. Выраженность вышеописанных изменений соответствовала II степени лечебного патоморфоза.
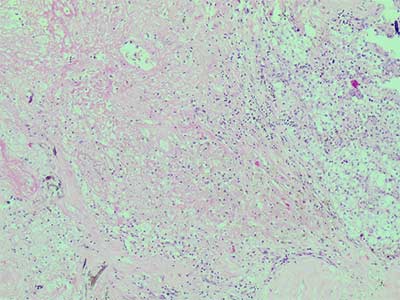
Рис.6. Выраженный лечебный патоморфоз: островки остаточной опухоли (на фото справа) расположены среди малоклеточной соединительной ткани. Гем.-эозин, х 100.
В апреле 2018 года пациент сообщил о подозрении на развитие метастатического поражения лимфатических узлов таза при контрольном обследовании по месту жительства (при предшествующих регулярных обследованиях признаки прогрессирования болезни не определялись). Пациенту было рекомендовано выполнение позитронно-эмиссионной томографии с последующим решением вопроса о тактике дальнейшего лечения. Таким образом, безрецидивный период после операции составил 22 месяца, период наблюдения от выявления первичной опухоли по данным КТ — 33 месяца.
Интеллектуальная собственность https://www.euroonco.ru
Заключение
Размер первичной опухоли перед первой операцией (более 5 см) и наличие в ней некрозов указывают на принадлежность описанной опухоли к «злокачественным» ПЭКомам в соответствии с критериями Folpe. Приведённый пример указывает на вероятную эффективность неоадъювантной терапии ПЭКомы при применении нестандартных схем фракционирования дистанционной лучевой терапии. Возможность повышения эффективности такого подхода видится в эскалации разовой и суммарной очаговых доз (возможно, до 7-8 Гр / 35-40 Гр соответственно, с последующей оценкой степени лечебного патоморфоза в удалённой опухоли). Вторым напрашивающимся выводом является необходимость выработки комплексного подхода к лечению больных злокачественной пекомой там, где это возможно: в данном случае первичное хирургическое лечение оказалось менее эффективным, чем последующее комплексное лечение по поводу рецидивной опухоли при том, что прогностическая неблагоприятность рецидивов в сравнении с первичными опухолями общеизвестна.
Список литературы
- Fadare O., Parkash V., Yilmaz Y., et al. Perivascular epithelioid cell tumor (PEComa) of the uterine cervix associated with intraabdominal «PEComatosis»: A clinicopathological study with comparative genomic hybridization analysis. World J Surg Oncol 2004;2:35. PMID: 15494070. DOI: 10.1186/1477-7819-2-35.
- Cuevas Herreros O., Escobar Lezcano L., Rodriguez Blaco M., Artigas Raventos V.. PEComa, a Rare Epithelioid Cell Tumor. Cir Esp 2015;93:e65—7. DOI: 10.1016/j.cireng.2013.07.034.
- Folpe A.L., Mentzel T., Lehr H.A., et al. Perivascular epithelioid cell neoplasms of soft tissue and gynecologic origin: a clinicopathologic study of 26 cases and review of the literature. Am J Surg Pathol 2005; 29:1558-75. PMID: 16327428.
- Hussain T., Al-Hamali S.. Pathophysiology and management aspects of adrenal angiomyolipomas. Ann R Coll Surg Engl 2012; 94:224-6. PMID: 22613297. DOI: 10.1308/003588412X13171221498541.
- Нечушкина И.В., Карселадзе А.И.. Пекомы. Обзор литературы и клиническое наблюдение. Саркомы костей, мягких тканей и опухоли кожи 2016;2:32-43.
- Bleeker J.S., Quevedo J.F., Folpe A.L.. «Malignant» Perivascular Epithelioid Cell Neoplasm: Risk Stratification and Treatment Strategies. Sarcoma. Volume 2012, Article ID 541626. DOI: 10.1155/2012/541626.
- Jeon I.S., Lee S.M.. Multimodal treatment using surgery, radiotherapy, and chemotherapy in a patient with a perivascular epithelioid cell tumor of the uterus. Journal of Pediatric Hematology/Oncology 2005;27:681—4. PMID: 16344678.
- Jeon I.S., Yi D.Y.. Acute lymphoblastic leukemia secondary to chemoradiotherapy for perivascular epithelioid cell tumor of uterus. Pediatric hematology and oncology 2009;26:85—8. PMID: 19322738. DOI: 10.1080/08880010902754859.
- Osei D.A., Alvandi F., Brooks J.S., Ogilvie C.M.. PEComa of the upper extremity: a unique case and description of an initial response to neoadjuvant chemotherapy. Sarcoma. Volume 2007, Article ID 53056. PMID: 18274609. DOI: 10.1155/2007/53056.
- Ong L.Y., Hwang W.S., Wong A., et al. Perivascular epithelioid cell tumour of the vagina in an 8 year old girl. Journal of Pediatric Surgery 2007;42(3):564—6. PMID: 17336201. DOI: 10.1016/j.jpedsurg.2006.10.050.
- Weinreb I., Howarth D., Latta E., et al. Perivascular epithelioid cell neoplasms (PEComas): four malignant cases expanding the histopathological spectrum and a description of a unique finding. Virchows Arch 2007;450(4):463—70. PMID: 17377813. DOI: 10.1007/s00428-007-0378-7.
- Yamashita K., Fletcher C.D.. PEComa presenting in bone: clinicopathologic analysis of 6 cases and literature review. American Journal of Surgical Pathology 2010;34(11):1622—9. PMID: 20975340. DOI: 10.1097/PAS.0b013e3181f5974f.


















