Менингеальные гемангиоперицитомы, или солитарные фиброзные опухоли, — редкие опухоли, тактика лечения которых остаётся дискутабельной, однако накопленные клинические данные указывают на необходимость проведения радикального удаления первичной опухоли с последующим курсом дистанционной лучевой терапии на хирургическое ложе в адекватных суммарных очаговых дозах для достижения наилучших показателей контроля болезни.
Американские патологи Arthur Purdy Stout и Margaret Ransone Murray в 1942 году впервые использовали термин «гемангиоперицитома» для описания опухоли мягких тканей, предположительно, происходящей из перицитов, с мономорфной популяцией компактных полигональных или веретенообразных клеток и стромальным сосудистым рисунком, ветвящимся наподобие «рогов оленя» (staghorn) [1]. Редкость выявления этих опухолей привела к тому, что работой, включающей описание наибольшего количества клинических наблюдений гемангиоперицитомы (включая детей), остаётся статья 1976 года [2].
Гемангиоперицитомы чаще всего поражают кожу и подкожную жировую клетчатку (34,5%), скелетные мышцы нижних конечностей (24,5%), забрюшинное пространство (24%), область головы и шеи (17%) [3]. Такая же вариабельность наблюдается и у пациентов детского возраста [4]. Учитывая происхождение её из клеток стенок капилляров, ни одна из локализаций этой опухоли не должна вызывать удивление.
Многолетние дискуссии позволили выяснить, что гемангиоперицитомы не только обладают схожими гистологическими особенностями с солитарными фиброзными опухолями, но и схожими генетическими изменениями: инверсия локуса 12q13, приводящая к слиянию генов NAB2 и STAT6, последний экспрессируется, что может быть выявлено с использованием иммуногистохимических методов. В результате, существует мнение об отсутствии необходимости использование термина «гемангиоперицитома». Для описания опухолей такого рода в центральной нервной системе из-за различий в признаках гемангиоперицитом и солитарных фиброзных опухолей использовались оба термина, однако в классификации Всемирной Организации Здравоохранения опухолей центральной нервной системы эти опухоли были объединены [5,6].
Менингеальные гемангиоперицитомы являются редкими опухолями оболочек головного мозга, в настоящий момент рассматриваемыми в качестве агрессивных вариантов солитарных фиброзных опухолей твёрдой мозговой оболочки. Они часто представляются крупными образованиями твёрдой мозговой оболочки с локальным агрессивным течением, часто распространяющимися сквозь свод черепа. При выполнении магнитно-резонансной томографии их трудно дифференцировать с гораздо более часто встречающимися менингиомами, но их схема лечения также включает хирургическое удаление с или без дистанционной лучевой терапией для снижения риска рецидивирования, который высок для этого вида опухолей. Степень злокачественности этих опухолей может варьировать от G1 до G3, что определяет агрессивность их течения [6].
Среди интракраниальных опухолей гемангиоперицитомы составляют менее 1% [7], среди менингеальных — 2-4% [8]. Чаще эти опухоли выявляются у тридцати- и сорокалетних пациентов, но до 10% случаев диагностируется у детей [9]. Несколько чаще с ними сталкиваются пациенты мужского пола: 1,4/1 [6,8].
Симптомы, вызванные такими опухолями, обычно связаны с масс-эффектом и варьируют в зависимости от её локализации. Головные боли, судорожные приступы, очаговая неврологическая симптоматика — всё это может симптомами болезни [9]. Вдобавок, до 20% гемангиоперицитом могут метастазировать отдалённо — обычно в печень, лёгкие, кости скелета [6,7,9], но также встречаются редкие варианты метастазирования, в частности, в почки [10,11].
Хирургическое удаление опухоли является основным методом лечения менингеальных гемангиоперицитом, при этом большое количество работ указывает на необходимость проведения послеоперационного курса дистанционной лучевой терапии с целью снижения риска развития рецидива в послеоперационной области. Далее представлен ряд работ, приводящих результаты ретроспективного анализа результатов лечения больных менингеальными гемангиоперицитомами.
Исследование Guthrie et al 1989 года описывает результаты лечения 44 больных с 1938 (когда этот диагноз ещё не был предложен) по 1987 год. Эта работа указывает на случаи операционной смертности (9% до 1974 года), а также повествует о 15-, 65- и 76%-ном риске развития рецидива через 1, 5 и 10 лет после выполнения хирургического вмешательства. По данным авторов работы проведение лучевой терапии после первой операции увеличивает среднее время до развития рецидива с 34 до 75 месяцев, а среднюю продолжительность жизни с 62 до 92 месяцев [12].
Работа Bastin и Mehta 1992 года сообщает о 90%-ном актуарном риске развития рецидива в течение 9 лет после проведения только хирургического лечения. Менее трети рецидивов случаются в течение первых пяти лет наблюдения, что может способствовать выработке превратного представления о высоком потенциале излечения менингеальной гемангиоперицитомы с помощью хирургического метода. По мнению авторов, лучевая терапия способна уменьшить риск развития локального рецидива и увеличить показатели безрецидивной и общей выживаемости таких больных. Ответ на лучевую терапию у таких опухолей зависим от суммарной очаговой дозы, и доза более 50 Гр способна обеспечить лучшие показатели безрецидивной выживаемости. Менингеальные гемангиоперицитомы характеризуются медленным, но последовательным ответом на лучевую терапию по данным МРТ, в отличие от других высоковаскуляризованных опухолей головного мозга (таких, как артериовенозные мальформации) [13].
В исследовании Uemura et al 1992 года описаны результаты лечения семерых больных интракраниальными гемангиоперицитомами, из которых у пятерых была выполнена предоперационная дистанционная лучевая терапия. Очевидный ответ опухоли на лучевую терапию по данным компьютерной и магнитно-резонансной томографии наблюдался уже после суммарных очаговых доз в 20-30 Гр, а суммарный показатель уменьшения объёма составил 80-90%, и такое уменьшение объёма опухоли наблюдалось в течение 5-7 месяцев после лечения. У тех пятерых больных, которым выполнялась предоперационная лучевая терапия, опухоли были удалены без осложнений и массивной кровопотери, а гистологическое исследование послеоперационного материала сообщало о выраженном лечебном патоморфозе в объёме облучённой опухоли. Авторы делают вывод о том, что предоперационная лучевая терапия может быть необходима в ситуациях, когда хирургическое удаление опухоли сопряжено с высокими рисками, а послеоперационная — даже в тех случаях, когда опухоль была удалена радикально [14].
Исследование Dufour et al 1998 года представляет результаты лечения 20 больных в французском центре с 1965 по 1995 годы. Авторы свидетельствуют о трудности предоперационной дифференциации менингеальных гемангиоперицитом и менингиом с использованием компьютерной и магнитно-резонансной томографии и рекомендуют ангиографию как наиболее эффективный метод. Все 20 пациентов были оперированы, но послеоперационная лучевая терапия была выполнена только 12 (60%) из них. Частота развития локального рецидива составила 45% (9 больных), из которых 88% (8 больных) представляли группу, в которой лучевая терапия не проводилась (то есть все больные этой группы). У троих (15%) пациентов в процессе наблюдения были выявлены метастазы за пределами органов нервной системы. В заключении авторы сообщают о достоверном (р<0,0001) снижении риска развития рецидива при использовании после тотального удаления опухоли лучевой терапии в суммарной очаговой дозе более 50 Гр. Радиохирургические методики могут быть назначены для лечения рецидивных опухолей менее 30 мм в наибольшем измерении [15].
В данное исследование был включён ещё один пациент, и авторы, изменив формирование групп анализа и критерии анализа, в работе 2001 года добавили следующие выводы: послеоперационная лучевая терапия снижает риск развития локального рецидива, но не развития метастазов в органах центральной нервной системы и вне неё, а также не исключает риск повторного рецидивирования. Наибольший размер рекомендованных к радиохирургии опухолей был уменьшен до 25 мм [16].
Работа Someya et al 2001 года повествует не только о возможностях послеоперационной лучевой терапии, но и о её использовании в качестве терапевтической опции при развитии метастатического процесса — как в веществе головного мозга, так и в костях скелета, правда, такому лечению были подвергнуты только двое из 4 больных, описанных в исследовании [17].
В исследовании Sheehan et al 2002 года приведены результаты выполнения стереотаксической радиохирургии с 1987 по 2001 год у 14 больных с 15 отдельными опухолями. Ранее пациентам были выполнены резекция опухоли транссфеноидальным доступом (1), краниотомия и резекция (27), эмболизация (1), конвенциональная лучевая терапия (7). Медиана периода наблюдения составила 21 месяц (среднее значение — 31,3 месяца, 5-76 месяцев). Средняя доза, подведённая к краю опухоли, составила 15 Гр. У 11 (79%) из 14 пациентов получилось достичь локального контроля над опухолями после радиохирургии, а 12 (80%) опухолей из 15 существенно уменьшились в размерах при последующем наблюдении. Двоим пациентам была проведена повторная радиохирургия по поводу региональных интракраниальных рецидивов, ни у одного из них не удалось достичь долгосрочных показателей локального контроля. Рецидивы после радиохирургии у троих пациентов развились через 12, 21 и 75 месяцев. 5-летние показатели локального контроля и общей выживаемости составили 76 и 100%, соответственно (по методу Каплан-Майера). Исследователи не смогли найти зависимость между предшествующей лучевой терапией и размером опухоли и локальным контролем. У 4 (29%) из 14 пациентов в процессе наблюдения развились отдалённые метастазы, таким образом радиохирургия не является способом предотвращения развития интра- и экстракраниальных метастазов, но может рассматриваться как опция лечения рецидивов после хирургического лечения и лучевой терапии [18].
Исследование было продолжено, и в 2010 году та же группа авторов представила данные лечения уже 21 больного, у которого радиохирургии были подвергнуты 28 отдельных опухолей (с 1989 по 2008 год). В предшествующем радиохирургии периоде больным проводились эмболизации (6), транскраниальные резекции (39), транссфеноидальные резекции (2), фракционированная лучевая терапия (8). Средние предписанная и максимальная дозы радиохирургии составили 17 и 40,3 Гр, соответственно. Повторная радиохирургия была использована для лечения 13 опухолей. Медиана периода наблюдения составила 68 месяцев (2-138). Рецидивы после радиохирургии были зафиксированы 11 (52,4%) из 21 больного гемангиоперицитомой. Из 28 опухолей 8 (28,6%) уменьшились в размерах, 5 (17,9%) стабилизировались, а 15 (53,6%) в конечном счёте запрогрессировали. Показатели выживаемости без признаков прогрессирования составили 90, 60,3 и 28,7% через 1, 3 и 5 лет после первичной радиохирургии на аппарате GammaKnife. Пятилетний показатель общей выживаемости составил 81%. У 4 (19%) из 21 пациента развились экстракраниальные метастазы. Предшествующая фракционированная лучевая терапия не показала достоверного влияния на контроль опухолей, подвергнутых радиохирургии [19].
Исследование Soyuer et al 2004 года повествует о результатах лечения 29 больных интракраниальной менингеальной гемангиоперицитомой с 1979 по 1999 годы. Исследователи получили достоверные различия в 5-летних показателях локального контроля после тотальной и субтотальной резекции опухоли: 84 и 38%, соответственно (р=0,003). Авторы делают вывод, основываясь не только на своих данных, но и анализе существовавшей на тот момент литературы, что тотальное удаление опухоли и последующая локальная лучевая терапия являются наилучшим подходом в инициальном лечении менингеальной гемангиоперицитомы [20].
Исследование Zweckberger et al 2011 года описывает результаты лечения 15 больных церебральной (10) и спинальной (5) гемангиоперицитомой G2 и G3. Анализ продемонстрировал ключевое значение тотального удаления опухоли в контроле прогрессирования болезни, потребность в проведении лучевой терапии при субтотальном удалении опухоли и гистологических признаках анаплазии (G3), а также отсутствие влияния химиотерапии на вероятность прогрессирования болезни. Из 4 пациентов, у которых впоследствии были выявлены отдалённые метастазы, два представляли группу гемангиоперицитом G2, что не позволяет считать данную форму доброкачественной опухолью (авторы даже вынесли этот постулат в название статьи) [21].
Исследование Kumar et al 2012 года сообщает о результатах лечения 15 больных с 2001 по 2011 год: семи пациентов с менингеальной гемангиоперицитомой G2 и восьми — G3. 13 больным после хирургического удаления опухоли была выполнена лучевая терапия с медианой суммарной очаговой дозы 50 Гр. Медиана показателя безрецидивной выживаемости составила 68 месяцев, у пятерых пациентов был зафиксирован локальный рецидив, ещё у одного — отдалённое метастазирование. Авторы рекомендуют проведение послеоперационной лучевой терапии всем пациентам вне зависимости от радикальности предшествующего хирургического вмешательства, а также настаивают на длительном периоде наблюдения таких больных, мотивируя это тем, что прогрессирование болезни может наступить спустя многие годы после окончания инициального лечения [8].
В исследовании Ghia et al 2013 года сообщается о результатах лечения 63 больных в период с 1979 по 2009 год. Пациенты были разделены на группы только хирургии и хирургии с послеоперационной лучевой терапией. Послеоперационная лучевая терапия была выполнена 39 (62%) больных. 5-, 10- и 15-летние показатели общей выживаемости составили 90, 68 и 28%, соответственно. Аналогичные показатели локального контроля составили 70, 37 и 20%, а выживаемости без метастазов — 85, 39 и 7%, соответственно. Проведение послеоперационной лучевой терапии достоверно улучшило показатели локального контроля (р=0,008), при этом наблюдалась достоверная разница в достижении локального контроля при подведении дозы ≥60 Гр в сравнении с меньшей суммарной очаговой дозой (р=0,045). Также улучшало показатель локального контроля тотальное удаление опухоли (р=0,03). При многовариантном анализе послеоперационная лучевая терапия (р=0,003) тотальное удаление опухоли (р=0,008) и суммарная очаговая доза ≥60 Гр (р=0,003) коррелировали с лучшими показателями локального контроля. При этом объём операции и проведение послеоперационной лучевой терапии не влияли на общую выживаемость пациентов. Тем не менее, авторы рекомендуют тотальное удаление опухоли с последующей лучевой терапией в дозе ≥60 Гр для достижения оптимальных показателей локального контроля [22].
Их выводы подтверждаются работой Melone et al 2014 года, в которой были проанализированы результаты лечения 43 больных (были прослежены 36 из них) интракраниальной гемангиоперицитомой с 1980 по 2010 год. Не было получено достоверных различий в показателях общей выживаемости тех больных, которым после операции была проведена дистанционная лучевая терапия (включая радиохирургию и протонную терапию), в сравнении с группой хирургического лечения (178 и 154 месяца, соответственно, р=0,2), но достоверные различия были получены в отношении продолжительности периода до развития рецидива (108 и 64 месяца, соответственно, р=0,04). С риском раннего рецидивирования также были ассоциированы размер опухоли не менее 7 см (р<0,05) и вовлечение синуса (р<0,05). С улучшением показателей общей выживаемости был ассоциирован наибольший объём резекции (р<0,05), а с худшими показателями общей выживаемости и периода до развития рецидива — анапластическая форма гемангиоперицитомы (G3) [23].
В работе Kim et al 2015 года были представлены результаты лечения 17 пациентов 1995 по 2014 год. Авторы сделали упор на роль объёмов хирургических вмешательств. Факторами, достоверно улучшающими показатели безрецидивной выживаемости оказались объём (то есть радикальность) хирургического вмешательства и проведение послеоперационной лучевой терапии (причём вне зависимости от радикальности хирургического вмешательства). В рамках исследования лучевая терапия проводилась за 30-40 фракций (медиана — 33) до суммарных очаговых доз 50-60 Гр (медиана — 57,57 Гр) [24].
В исследовании Noh et al 2015 года, несмотря на то, что послеоперационную лучевую терапию выполнили только 3 пациентам из 15 повергнутых хирургическому вмешательству (был зафиксирован только один истинный рецидив — в группе без лучевой терапии — и два случая поражения других областей головного мозга — по одному в каждой группе), авторы делают выводы о том, что лучевая терапия может быть необходима для повышения вероятности предотвращения развития рецидива [25].
В исследовании Rutkowski et al 2011 года приводятся результаты лечения 14 больных с рецидивами интракраниальной гемангиоперицитомы. 8 больным была проведена повторная резекция, в послеоперационном периоде четверым из них была выполнена дистанционная лучевая терапия, одному — радиохирургия — и ещё одному — брахитерапия. 6 больным была проведена радиохирургия. У 9 пациентов развился второй рецидив с медианой в 3,5 года после лечения первого рецидива. 9 пациентов умерли с медианой продолжительности жизни в 7,9 лет после лечения рецидива. Факторами, ассоциированными с увеличением времени до развития второго рецидива оказались локализация за пределами задней черепной ямки (р<0,05) и сочетание хирургического вмешательства и дистанционной лучевой терапии (р<0,05). Добавление дистанционной лучевой терапии достоверно увеличило показатель общей выживаемости в сравнении с только хирургическим лечением (р<0,05). Радиохирургия на аппарате GammaKnife была ассоциирована с более ранним развитием второго рецидива в сравнении со стратегиями, основанными на хирургическом лечении (р<0,05). А вторы делают вывод о том, что резекция рецидива гемангиоперицитомы с последующей дистанционной лучевой терапией должна быть первой терапевтической опцией в такой ситуации [26].
Клинический случай. Пациент Г. 57 лет.
Диагноз: анапластическая гемангиоперицитома передне-средней трети фалькса, состояние после хирургического лечения. Продолженный рост опухоли, состояние после лучевой терапии. Рецидив заболевания, состояние после стереотаксической радиотерапии.
В течение длительного времени предъявлял жалобы на головные боли. С 2005 года беспокоили эпизоды повышения артериального давления до 180/100 мм рт. ст.. Ночью 14.10.13 — эпизод кратковременной дезориентации на фоне повышения артериального давления до 210/110 мм рт.ст.
По данным МРТ головного мозга от 29.10.13 в передних отделах серпа большого мозга между лобными долями определяется неправильной овальной формы образование размерами 53×45×50 мм с неровными чёткими контурами, компримирующее вещество головного мозга, больше левой лобной доли — расценена как менингиома фалькса.
11.11.13 — удаление опухоли передне-средней трети фалькса.
Гистологическое исследование: анапластическая гемангиоперицитома, G3.
В послеоперационном периоде были отмечены нестабильная гемодинамика, потребовавшая вазопрессорной поддержки, подъёмы температуры тела до 37,7оС (с третьих суток после операции проводилась антибиотикотерапия меронемом ввиду сохранявшейся лихорадки), проводилась продлённая искусственная вентиляции лёгких ввиду отсутствия самостоятельного дыхания. По данным послеоперационной КТ данные за гематому получены не были, определялся отёк левого полушария головного мозга. С 14.11.13 было отмечено улучшение уровня сознания до ясного (до этого — глубокое оглушение), правосторонний гемипарез регрессировал до 4 баллов (до этого — до 1-2 баллов в руке и 2-3 баллов в ноге). По данным КТ от 15.11.13 определялся послеоперационный отёк прежнего объёма. В последующем беспокоили жалобы на слабость и дискоординацию правой верхней конечности, головные боли, был эпизод судорог в правой ноге.
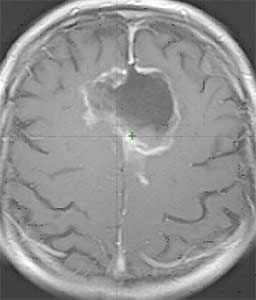
Рисунок 1. Рецидивная опухоль по данным МРТ от 12.12.13 (до начала радикального курса дистанционной лучевой терапии).
По данным МРТ головного мозга от 12.12.13 в передне-средней трети фалькса определяется объёмное образование кистозно-солидной структуры размерами 50×40 мм с перифокальным отёком. При контрастировании образование интенсивно неоднородно накапливает контрастный препарат по периферии (рисунок 1: Рецидивная опухоль по данным МРТ от 12.12.13 (до начала радикального курса дистанционной лучевой терапии)).
С 06.02.14 по 25.02.14 проведён радикальный курс дистанционной лучевой терапии на ложе удалённой первичной опухоли и остаточную опухоль с отступом в окружающие ткани мозга, РОД 3 Гр, 5 раз в неделю, СОД 42 Гр (52 иГр), с одновременным «бустом» на остаточную опухоль, РОД 3,3 Гр, 5 раз в неделю, СОД 46,2 Гр (60 иГр) c применением технологии RapidArc. Курс дистанционной лучевой терапии проведён на фоне дегидратационной терапии дексаметазоном (по 13.02.14 — по 4 мг утром ежедневно; с 14.02.13 — по 4 мг утром через день). В результате проведения курса дистанционной лучевой терапии прекратились жалобы на чувство тяжести в голове, в плечах.
При дальнейшем наблюдении пациента определялся полный эффект в отношении опухоли фалькса, в частности, по данным, ПЭТ-КТ с 11С-метионином от 06.04.16 и МРТ от 31.10.16.
В марте 2017 года появились жалобы на прогрессирующую общую слабость.
Рецидив заболевания в мае 2017 года (через 38 месяцев после окончания курса дистанционной лучевой терапии): по данным МРТ от 11.05.17 в коре и белом веществе медиальных отделов лобных долей, передних отделах серпа большого мозга, стволе мозолистого тела определяется ликворосодержащая полость до 50×49×31 мм (при исследовании от 31.10.16 была до 48×46×30 мм). По заднему краю послеоперационной полости в левой лобной доле определяется участок накопления контрастного препарата до 5×3 мм (не определялся при исследовании от 31.10.16) (рисунки 2,3: рецидивная опухоль по данным МРТ от 11.05.17 (до начала курса стереотаксической радиотерапии)).
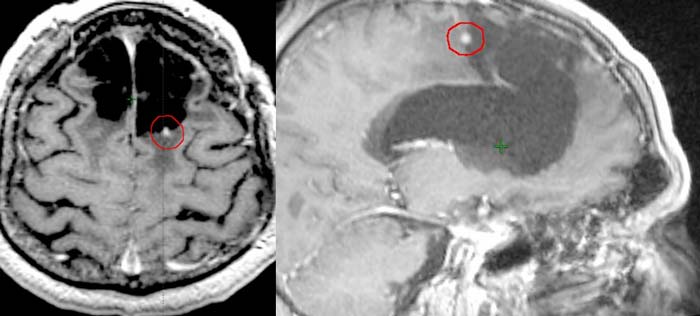
Рисунки 2 и 3. Рецидивная опухоль по данным МРТ от 11.05.17 (до начала курса стереотаксической радиотерапии).
С 22.06.17 по 27.06.17 проведён курс стереотаксической радиотерапии на рецидивную опухоль по заднему краю послеоперационной полости в левой лобной доле головного мозга, РОД 7 Гр, 5 раз в неделю, СОД 28 Гр.
При последующем наблюдении определялся полный эффект стереотаксической радиотерапии рецидивной опухоли до выполнения 18.12.17 контрольной МРТ головного мозга. По данным этого исследования на месте подвергнутого стереотаксической радиотерапии очага был выявлен участок накопления контрастного препарата до 7×5х7 мм — зона постлучевого некроза или возобновление роста рецидивной опухоли.
По данным МРТ от 22.03.18, выполненной в рамках динамического наблюдения, размеры участка накопления контрастного препарата практически не изменились — 9×5х6 мм, кзади от него появился ещё один очажок накопления контрастного препарата до 3 мм. Учитывая удовлетворительное состояние пациента, было рекомендовано продолжить динамическое наблюдение (рисунки 4, 5: зона накопления контрастного препарата на месте подвергнутой стереотаксической радиотерапии рецидивной опухоли по данным МРТ от 22.03.18 (постлучевой некроз? рецидивная опухоль?)).
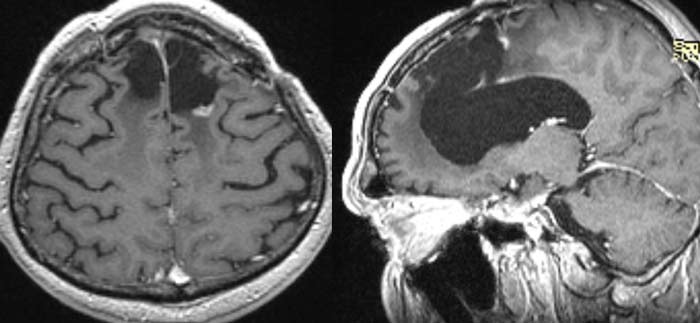
Рисунки 4 и 5. Зона накопления контрастного препарата на месте подвергнутой стереотаксической радиотерапии рецидивной опухоли по данным МРТ от 22.03.18 (постлучевой некроз? рецидивная опухоль?).
В настоящее время пациент наблюдается в течение 50 месяцев после окончания радикального курса дистанционной лучевой терапии и 10 месяцев — курса стереотаксической радиотерапии.
Заключение. Данный клинический случай демонстрирует эффективность проведения дистанционной лучевой терапии у больного с менингеальной гемангиоперицитомой. Относительно небольшая продолжительность безрецидивного периода (сравнимая с приведённой в ряде исследований) не должна рассматриваться в контексте неуспеха первичного лечения: в клинической ситуации данного больного обращают на себя внимание два очевидных негативных фактора: высокая степень злокачественности опухоли и нерадикальность хирургического вмешательства. Кроме того, своевременное выявление рецидивной опухоли малых размеров позволило провести курс стереотаксической радиотерапии, что даёт надежду на достижение нового периода ремиссии у данного больного.
Редкость опухоли не позволяет разработать единый стандарт лечения менингеальной (интракраниальной) геманиоперицитомы, однако авторы данной статьи считают целесообразным на этапе первичного лечения этой опухоли проводить хирургическое её удаление с последующей лучевой терапией (вероятно, с суммарными очаговыми дозами не менее 60 Гр и точно никак не меньшими 50 Гр; особенно актуально в случае анапластического характера опухоли). В случае развития рецидива при отсутствии в анамнезе дистанционной лучевой терапии следует проводить его лечение по плану лечения первичной опухоли. Варианты радиохирургии и стереотаксической радиотерапии, учитывая показанные в исследованиях меньшие показатели локального контроля, следует использовать при наличии фракционированной лучевой терапии в анамнезе или в рамках клинических исследований (проведение которых маловероятно, учитывая редкость постановки диагноза менингеальной гемангиоперицитомы).
Список литературы
- Stout A.P., Murray M.R. Hemangiopericytoma. A vascular tumor featuring Zimmermann’s pericytes. Annals of Surgery. 1942, v. 116-1, p. 26-33.
- Enzinger F.M., Smith B.H. Hemangiopericytoma. An analysis of 106 cases. Hum. Pathol. 1976, v. 7, p. 61-66.
- В. А. Алиев, Э. Р. Мусаев, И. Ш. Татаев, и др. Редкое наблюдение злокачественной гемангиоперицитомы малого таза. Онкология. Журнал им. П.А. Герцена. 2015, т. 4(2), с. 64-70.
- Перевощиков А.Г., Васильев В.В., Турабов И.А., Близнюков О.П.. Инфантильная гемангиоперицитома: клинико-морфологический анализ десяти случаев. Вопросы онкологии. 2009, т. 1, с. 72-78.
- Мацко Д.Е., Мацко М.В., Имянитов Е.Н. Нейроонкология. Практическая онкология. 2017, т. 18 (1), с. 103-114.
- Louis D.N., Ohgaki H., Wiestler O.D., Cavenee W.K.. «WHO Classification of Tumours of the Central Nervous System. 4th Edition Revised».
- Chiechi M.V., Smirniotopoulos J.G., Mena H.. Intracranial hemangiopericytomas: MR and CT features. AJNR Am J Neuroradiol. 1996, v. 17 (7), p. 1365-1371.
- Kumar N., Kumar R., Kapoor R., et al. Intracranial meningeal hemangiopericytoma: 10 years experience of a tertiary care Institute. Acta Neurochir (Wien). 2012, v. 154 (9), p. 1647-1651.
- Smith A.B., Horkanyne-Szakaly I., Schroeder J.W., et al. From the radiologic pathology archives: mass lesions of the dura: beyond meningioma-radiologic-pathologic correlation. Radiographics. 2014, v. 34 (2), p. 295-312.
- Wei G., Kang X., Liu X., Tang X., et al. Intracranial meningeal hemangiopericytoma: Recurrences at the initial and distant intracranial sites and extraneural metastases to multiple organs. Mol Clin Oncol. 2015, v. 3 (4), p. 770-774.
- Chan J.K.I., Cheuk W., Cheong Ho L., Wen J.M.. Recurrent Meningeal Hemangiopericytoma with Multiple Metastasis and Hypoglycemia: A Case Report. Case Reports in Medicine. 2012, v. 2012, Article ID 628756.
- Guthrie B.L., Ebersold M.J., Scheithauer B.W., Shaw E.G.. Meningeal hemangiopericytoma: histopathological features, treatment, and long-term follow-up of 44 cases. Neurosurgery. 1989, v. 25 (4), p. 514-522.
- Bastin K.T., Mehta M.P.. Meningeal hemangiopericytoma: defining the role for radiation therapy. J Neurooncol. 1992, v. 14 (3), p. 277-287.
- Uemura S., Kuratsu J., Hamada J., et al. Effect of radiation therapy against intracranial hemangiopericytoma. Neurol Med Chir (Tokyo). 1992, v. 32 (6), p. 328-332.
- Dufour H., Bouillot P., Figarella-Branger D., et al. [Meningeal hemangiopericytomas. A retrospective reciew of 20 cases] [Article in French]. Neurochirurgie. 1998, v. 44 (1), p. 5-18.
- Dufour H., Métellus P., Fuentes S., et al. Meningeal hemangiopericytoma: a retrospective study of 21 patients with special review of postoperative external radiotherapy. Neurosurgery. 2001, v. 48(4), p. 756-762.
- Someya M., Sakata K.I., Oouchi A., et al. Four cases of meningeal hemangiopericytoma treated with surgery and radiotherapy. Jpn J Clin Oncol. 2001, v. 31 (11), p. 548-552.
- Sheehan J., Kondziolka D., Flickinger J., Lunsford L.D.. Radiosurgery for treatment of recurrent intracranial hemangiopericytomas. Neurosurgery. 2002, v. 51 (4), p. 905-910.
- Olson C., Yen C., Schlesinger D., Sheehan J.. Radiosurgery for intracranial hemangiopericytomas: outcomes after initial and repeat Gamma Knife surgery. J Neurosurg. 2010, v. 112 (1), p. 133–139.
- Soyuer S., Chang E.L., Selek U., et al. Intracranial meningeal hemangiopericytoma: the role of radiotherapy: report of 29 cases and review of the literature. Cancer. 2004, v. 100 (7), p. 1491-1497.
- Zweckberger K., Jung C.S., Mueller W., et al. Hemangiopericytomas grade II are not benign tumors. Acta Neurochir. 2011, v. 153 (2), p. 385–394.
- Ghia A.J., Chang E.L., Allen P.K., et al. Intracranial hemangiopericytoma: patterns of failure and the role of radiation therapy. Neurosurgery. 2013, v. 73 (4), p. 624-630.
- Melone A.G., D’Elia A., Santoro F., et al. Intracranial hemangiopericytoma—our experience in 30 years: a series of 43 cases and review of the literature. World Neurosurg. 2014, v. 81 (3-4), p. 556-562.
- Kim Y.J., Park J.H., Kim Y.I., Jeun S.S.. Treatment Strategy of Intracranial Hemangiopericytoma. Brain Tumor Res Treat. 2015, v. 3 (2), p. 68-74.
- Noh S.H., Lim J.J., Cho K.G.. Intracranial Hemangiopericytomas: A Retrospective Study of 15 Patients with a Special Review of Recurrence. J Korean Neurosurg Soc. 2015, v. 58 (3), p. 211-216.
- Rutkowski M.J., Bloch O., Jian B.J, et al. Management of recurrent intracranial hemangiopericytoma. J Clin Neurosci. 2011, v. 18 (11), p. 1500-1504.


















